
- Pengarang Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:39.
- Diubah suai terakhir 2025-01-22 17:06.
Setiap elemen pelepasan spektrum adalah berbeza kerana setiap elemen mempunyai a berbeza set tahap tenaga elektron. Pelepasan garisan sepadan dengan perbezaan antara pelbagai pasangan dari banyak aras tenaga. The garisan (foton) dipancarkan apabila elektron jatuh dari orbital tenaga yang lebih tinggi kepada tenaga yang lebih rendah.
Selain itu, mengapakah unsur yang berbeza menghasilkan bilangan garis spektrum yang berbeza?
Frekuensi adalah ciri sifat nukleus dan nombor elektron yang diedarkan di antara pelbagai “cengkerang.” Mengikut mekanik kuantum, terdapat maksimum sebilangan elektron yang dibenarkan dalam setiap petala terikat. Inilah sebabnya elemen yang berbeza mempunyai berbeza frekuensi pelepasan diskret.
Kedua, mengapa beberapa garis spektrum lebih terang daripada yang lain? Dalam hidrogen spektrum , beberapa garis spektrum adalah lebih terang daripada yang lain bergantung pada tahap tenaga mereka. Ini garis terang menunjukkan bahawa elektron telah melompat dari tahap tenaga yang lebih tinggi ke tahap tenaga yang lebih rendah. Oleh itu dalam hidrogen spektrum beberapa baris adalah lebih terang daripada yang lain.
Dalam hal ini, apakah yang diwakili oleh warna berbeza dalam spektrum garis Mengapakah spektrum bagi setiap elemen unik?
Setiap elemen mempunyai sendiri spektrum garis yang unik dan oleh itu dirujuk sebagai "cap jari" untuk sesuatu tertentu unsur . The spektrum bagi setiap elemen adalah unik kerana setiap elemen mengandungi bilangan elektron yang berbeza dan dengan itu berbeza tahap tenaga.
Mengapakah setiap elemen mengeluarkan warna yang berbeza?
Pemanasan an atom merangsang elektronnya dan mereka melompat ke tahap tenaga yang lebih tinggi. Apabila elektron kembali ke tahap tenaga yang lebih rendah, mereka memancarkan tenaga dalam bentuk cahaya. Setiap elemen mempunyai a berbeza bilangan elektron dan a berbeza set tahap tenaga. Oleh itu, setiap unsur yang dipancarkan set sendiri warna.
Disyorkan:
Bagaimanakah spektrum pelepasan atom berbeza daripada spektrum berterusan?

Spektrum berterusan: spektrum yang mempunyai semua panjang gelombang tanpa jurang dalam julat yang luas. Spektrum pelepasan: apabila elektron dalam keadaan teruja bergerak ke tahap tenaga yang lebih rendah, ia mengeluarkan sejumlah tenaga sebagai foton. Spektrum untuk peralihan ini terdiri daripada garisan kerana tahap tenaga dikuantisasi
Adakah masuk akal untuk mencari persamaan garis selari dengan garis tertentu dan melalui titik pada garis yang diberikan?

Persamaan garis yang selari atau berserenjang dengan garis tertentu? Jawapan yang mungkin: Kecerunan garis selari adalah sama. Gantikan cerun yang diketahui dan koordinat titik pada garis lain ke dalam bentuk cerun titik untuk mencari persamaan garis selari
Mengapakah spektrum serapan untuk klorofil a dan spektrum tindakan untuk fotosintesis berbeza?
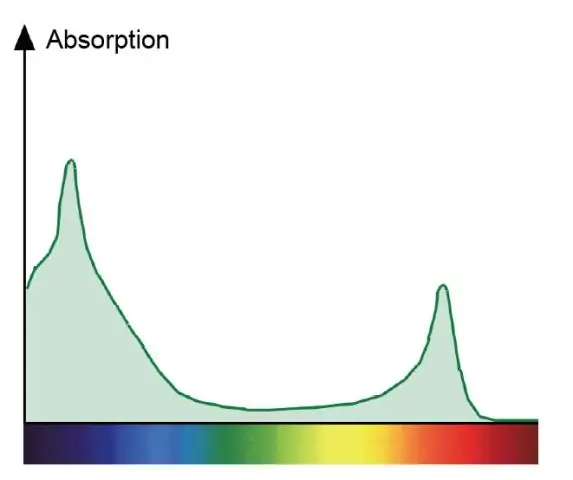
Spektrum serapan menunjukkan semua warna cahaya yang diserap oleh tumbuhan. Spektrum tindakan menunjukkan semua warna cahaya yang digunakan dalam fotosintesis. Klorofil adalah pigmen hijau yang menyerap merah dan biru dan mengambil bahagian dalam fotosintesis secara langsung
Mengapakah CDCl3 digunakan sebagai pelarut untuk merekodkan spektrum NMR bagi sebatian?

Ia boleh dengan mudah diasingkan daripada sebatian selepas melarutkannya kerana ia bersifat meruap jadi mudah tersejat. Oleh kerana kehadiran atom bukan hidrogen ia tidak mengganggu dalam penentuan spektrum NMR. Memandangkan ia adalah pelarut yang telah dideuterasi, maka puncaknya boleh dikenal pasti dengan mudah dalam NMR dengan skala rujukan TMS
Apakah nilai yang mungkin bagi L bagi setiap nilai n?

Subkulit. Bilangan nilai nombor orbitlangular l juga boleh digunakan untuk mengenal pasti bilangan subkulit dalam kulit elektron utama: Apabila n = 1,l= 0 (l mengambil satu nilai dan dengan itu hanya ada satu subkulit) Apabila n = 2 , l= 0, 1 (mengambil dua nilai dan dengan itu terdapat dua subkulit yang mungkin)
