
- Pengarang Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:39.
- Diubah suai terakhir 2025-01-22 17:05.
Disebabkan oleh mereka tinggi caj nuklear berkesan, halogen ialah sangat elektronegatif . Oleh itu, mereka adalah sangat reaktif dan boleh memperoleh elektron melalui tindak balas dengan unsur lain. Halogen boleh berbahaya atau maut kepada organisma biologi dalam kuantiti yang mencukupi.
Juga perlu diketahui, mengapa kumpulan 17 mempunyai keelektronegatifan tertinggi?
Keelektronegatifan meningkat sepanjang tempoh, dan menurun ke bawah a kumpulan . Oleh itu, fluorin mempunyai keelektronegatifan tertinggi daripada semua elemen. Kerana fluorin mempunyai tujuh elektron valens, ia hanya memerlukan satu elektron lagi untuk mencapai konfigurasi gas mulia (lapan elektron valens).
Seseorang juga mungkin bertanya, apakah keelektronegatifan halogen? Definisi bagi keelektronegatifan ialah tarikan unsur untuk lebih banyak elektron. Oleh itu VIIA atau Halogen akan mempunyai yang tertinggi keelektronegatifan mana-mana elemen dalam baris, atau noktahnya. Nombor Florine 9 F199 mempunyai yang tertinggi keelektronegatifan mana-mana unsur dalam jadual berkala pada 4.0.
Ketahui juga, halogen manakah yang mempunyai keelektronegatifan tertinggi?
Fluorin
Mengapa halogen dipanggil begitu?
Kumpulan 17 elemen ialah dipanggil halogen kerana halogen ialah perkataan Greek yang bermaksud 'menghasilkan garam'. Halogen termasuk fluorin, klorin, bromin, iodin dan astatin. Kesemuanya bukan logam. Mereka bertindak balas dengan logam untuk membentuk sebatian dipanggil garam.
Disyorkan:
Mengapakah bahan tulen mempunyai takat lebur yang lebih tinggi?

Peranan daya antara molekul Daya ini mesti terganggu apabila bahan cair, yang memerlukan input tenaga. Input tenaga diterjemahkan kepada suhu tinggi. Jadi, semakin kuat daya yang mengikat pepejal, semakin tinggi takat leburnya
Mengapakah etil alkohol mempunyai takat didih yang lebih tinggi daripada metil alkohol?

Etanol mempunyai takat didih yang lebih tinggi daripada Metanol. Oleh itu, lebih banyak tenaga diperlukan untuk mengatasi daya antara molekul, mengakibatkan peningkatan takat didih/lebur
Mengapakah dataran tinggi dipanggil dataran tinggi?

Jawapan: Dataran tinggi dipanggil 'tanah meja' kerana ia menyerupai meja dalam erti kata yang tinggi dan tinggi. Pada asasnya, 'Plateau' ialah perkataan Perancis untuk dataran tinggi dan seperti namanya, ia adalah kawasan darat yang sangat rata dan tinggi di atas paras laut
Mengapakah air mempunyai takat lebur yang tinggi?
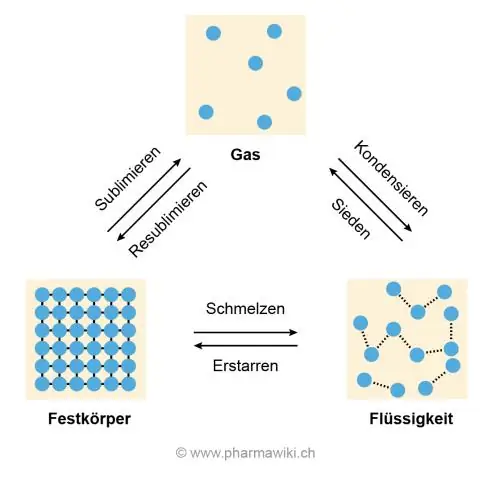
Punca suhu lebur dan pendidihan yang tinggi ialah ikatan hidrogen antara molekul air yang menyebabkan molekul air melekat dan tidak boleh ditarik iaitu apa yang berlaku apabila ais mencair dan air mendidih menjadi gas
Mengapakah Aluminium mempunyai takat lebur yang lebih tinggi daripada natrium?

Sepanjang tempoh itu, valensi meningkat (daripada valensi 1 dalam natrium kepada valensi 3 dalam aluminium) supaya atom logam boleh menyahlokasi lebih banyak elektron untuk membentuk lebih banyak kation bercas positif dan lautan elektron terdelokalisasi yang lebih besar. Oleh itu ikatan logam menjadi lebih kuat dan takat lebur meningkat daripada natrium kepada aluminium
